- Тайны стабильности: Как мы разгадали секреты расчета буферной емкости и почему это изменило наш мир
- Что такое буферная система и зачем она нам?
- Погружение в концепцию буферной емкости
- Математические основы: Уравнение Гендерсона-Хассельбаха
- Методы расчета буферной емкости: От теории к практике
- Метод титрования
- Формула Ван Слайка (Van Slyke Equation)
- Пример расчета буферной емкости
- Графический метод
- Оптимизация буферных систем: Искусство и наука
- Типичные ошибки и подводные камни при расчете буферной емкости
- Практические применения буферной емкости: От лаборатории до производства
Тайны стабильности: Как мы разгадали секреты расчета буферной емкости и почему это изменило наш мир
В бесконечном потоке информации, окружающем нас, есть концепции, которые кажутся сложными и академичными, но на самом деле пронизывают нашу повседневную жизнь, от биологических процессов внутри нас до промышленных масштабов производства. Одной из таких краеугольных и удивительно важных идей является "буферная емкость". Мы, как заядлые исследователи и рассказчики, давно задавались вопросом: что это за невидимая сила, которая позволяет системам сохранять стабильность даже при внешних воздействиях? И как, черт возьми, мы можем ее измерить или, еще лучше, предсказать?
Наше путешествие в мир буферной емкости началось не с сухих учебников, а с реальных проблем, с которыми сталкиваются ученые, инженеры и даже повара. Мы видели, как точное поддержание pH критически важно для ферментативных реакций в лаборатории, для стабильности лекарственных препаратов на аптечной полке и даже для идеальной текстуры йогурта. И каждый раз, когда мы сталкивались с задачей стабилизации кислотности или щелочности, мы неизменно возвращались к буферным системам. Именно тогда мы осознали, что просто знать о буферах недостаточно – нужно понимать их "силу", их способность противостоять изменениям, то есть их буферную емкость.
Эта статья — это не просто теоретический экскурс. Это наш личный опыт, наши открытия и, да, наши ошибки на пути к полному пониманию того, как рассчитывать буферную емкость. Мы поделимся с вами не только формулами, но и интуитивным пониманием, практическими советами и, возможно, вдохновением для ваших собственных исследований. Мы верим, что после прочтения вы не только сможете с уверенностью подойти к расчету буферной емкости, но и оцените ее глубокое значение в самых разных областях. Приготовьтесь, это будет увлекательное погружение!
Что такое буферная система и зачем она нам?
Прежде чем мы углубимся в сложные расчеты, давайте освежим в памяти, что же такое буферная система и почему она так важна. По сути, буферная система – это раствор, способный поддерживать относительно постоянное значение pH даже при добавлении умеренных количеств кислоты или основания. Представьте себе некий "защитный щит" для уровня кислотности. Это не магия, а химия, основанная на уникальном взаимодействии компонентов.
Обычно буферный раствор состоит из слабой кислоты и ее сопряженного основания (например, уксусная кислота и ацетат натрия) или слабой основы и ее сопряженной кислоты (например, аммиак и хлорид аммония). Когда мы добавляем сильную кислоту в такую систему, сопряженное основание буфера немедленно нейтрализует ее, предотвращая резкое падение pH. И наоборот, если добавить сильное основание, слабая кислота буфера вступит в реакцию, не давая pH резко подняться. Это динамическое равновесие и делает буферы такими незаменимыми.
Зачем же нам нужны эти буферы? Применений бесчисленное множество. В наших организмах кровь представляет собой сложную буферную систему, поддерживающую pH в очень узких пределах (около 7.35-7.45), что критично для выживания. В лабораториях мы используем буферы для создания оптимальных условий для химических реакций, роста клеток или работы ферментов. В промышленности они обеспечивают стабильность продуктов питания, напитков, косметики и лекарств, предотвращая их порчу или изменение свойств. Понимание и умение работать с буферными системами – это ключ к контролю и предсказуемости в бесчисленных процессах.
Погружение в концепцию буферной емкости
Теперь, когда мы понимаем, что такое буфер, логично задаться вопросом: насколько "силен" этот щит? Какое количество кислоты или основания он может поглотить, прежде чем его pH начнет существенно меняться? Именно на этот вопрос отвечает концепция буферной емкости. Буферная емкость – это количественная мера способности буферного раствора сопротивляться изменениям pH при добавлении кислоты или основания. Мы обозначаем ее символом β (бета).
Важно понимать, что буферная емкость не является бесконечной. У каждого буфера есть свой предел. Рано или поздно, если мы продолжим добавлять кислоту или основание, мы "истощим" один из компонентов буферной пары, и pH начнет резко изменяться. Это похоже на губку: она впитывает воду, но только до определенного момента, после чего перестает быть эффективной.
На буферную емкость влияют два основных фактора:
- Концентрация компонентов буфера: Чем выше концентрация слабой кислоты и ее сопряженного основания (или слабой основы и ее сопряженной кислоты), тем большее количество H+ или OH— ионов они смогут нейтрализовать. То есть, более концентрированный буфер будет иметь бóльшую буферную емкость.
- Соотношение концентраций компонентов буфера и близость к pKa: Буферная емкость максимальна, когда концентрации слабой кислоты и ее сопряженного основания равны. В этом случае pH буфера равен pKa слабой кислоты. По мере того как соотношение концентраций отклоняется от 1:1, буферная емкость снижается, особенно когда один из компонентов становится доминирующим.
Качественно мы можем представить это так: буфер работает лучше всего вблизи своего pKa, и чем больше "запаса" реагентов у него есть, тем дольше он сможет поддерживать стабильность.
Математические основы: Уравнение Гендерсона-Хассельбаха
Чтобы перейти от качественного понимания к количественному расчету, нам потребуется надежный математический инструмент. И здесь на помощь приходит одно из самых элегантных и широко используемых уравнений в химии – уравнение Гендерсона-Хассельбаха. Оно позволяет нам связать pH буферного раствора с pKa слабой кислоты и соотношением концентраций ее сопряженных форм.
Формула выглядит следующим образом:
pH = pKa + log10 ([A—] / [HA])
Где:
- pH – это водородный показатель раствора.
- pKa – это отрицательный десятичный логарифм константы диссоциации слабой кислоты (Ka). Она характеризует силу кислоты.
- [A—] – это молярная концентрация сопряженного основания (или соли слабой кислоты).
- [HA] – это молярная концентрация слабой кислоты.
Это уравнение – настоящий "швейцарский нож" для химиков. Оно позволяет нам не только рассчитать pH буфера, зная его состав, но и, что не менее важно, определить соотношение [A—]/[HA], необходимое для достижения желаемого pH. Именно благодаря ему мы можем проектировать буферные системы с заданными свойствами. И, как мы увидим далее, это уравнение является отправной точкой для понимания и расчета буферной емкости.
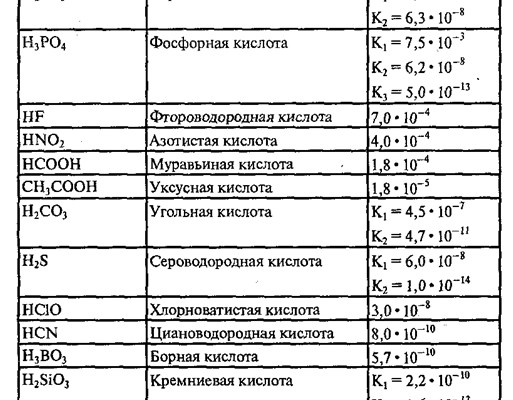
Давайте рассмотрим несколько распространенных буферных систем и их характерные pKa значения, чтобы наглядно представить, с чем мы имеем дело:
| Буферная система | Слабая кислота (HA) | Сопряженное основание (A—) | Приблизительное значение pKa | Рабочий диапазон pH |
|---|---|---|---|---|
| Ацетатный буфер | Уксусная кислота (CH3COOH) | Ацетат-ион (CH3COO—) | 4.76 | 3.76 ౼ 5.76 |
| Фосфатный буфер | Дигидрофосфат-ион (H2PO4—) | Гидрофосфат-ион (HPO42-) | 7.21 | 6.21 ౼ 8.21 |
| Аммиачный буфер | Ион аммония (NH4+) | Аммиак (NH3) | 9.25 | 8.25 — 10.25 |
| Карбонатный буфер | Бикарбонат-ион (HCO3—) | Карбонат-ион (CO32-) | 10.33 | 9.33 — 11.33 |
Рабочий диапазон pH обычно составляет pKa ± 1, поскольку за пределами этого диапазона буферная емкость значительно снижается. Это важный момент, который мы всегда учитываем при выборе буфера для конкретной задачи.
Методы расчета буферной емкости: От теории к практике
Теперь, когда мы прочно стоим на теоретическом фундаменте, пришло время перейти к самому интересному – к методам расчета буферной емкости. Мы рассмотрим как экспериментальные, так и теоретические подходы, которые позволяют нам количественно оценить "силу" буфера.
Метод титрования
Одним из самых наглядных и прямых способов определения буферной емкости является метод титрования. Он позволяет нам экспериментально увидеть, как буфер противостоит изменению pH. Процесс достаточно прост: мы берем определенный объем буферного раствора и постепенно добавляем к нему стандартный раствор сильной кислоты или сильного основания, одновременно отслеживая изменения pH с помощью pH-метра.
Полученные данные затем используются для построения кривой титрования – графика зависимости pH от объема добавленного титранта. На такой кривой мы наблюдаем относительно пологий участок, где pH изменяется незначительно, даже при добавлении значительных объемов кислоты или основания. Этот пологий участок и есть область максимальной буферной емкости. Когда буфер исчерпывается, кривая резко уходит вверх или вниз, сигнализируя об "истощении" буферной системы.
Буферная емкость (β) может быть определена как количество молей сильной кислоты или основания, которое необходимо добавить к 1 литру буферного раствора, чтобы изменить его pH на 1 единицу. Математически это выражается как:
β = dC / dpH
Где dC – это изменение концентрации добавленной кислоты или основания, а dpH – соответствующее изменение pH. На практике, мы берем небольшой интервал изменения pH (например, 0.1 единицы) и смотрим, сколько кислоты/основания потребовалось для этого изменения.
"Химия – это не только наука о том, что происходит, но и о том, почему это происходит, и как мы можем этим управлять."
– Лайнус Полинг
Формула Ван Слайка (Van Slyke Equation)
Для более точного и теоретического расчета буферной емкости мы часто обращаемся к формуле Ван Слайка. Эта формула позволяет нам рассчитать буферную емкость (β) при определенном pH, основываясь на концентрации компонентов буфера и константе диссоциации слабой кислоты. Она учитывает не только буферную пару, но и вклад автопротолиза воды.
Общая форма уравнения Ван Слайка для буферной системы, состоящей из слабой кислоты HA и ее сопряженного основания A—, при заданной общей концентрации буфера Cобщ = [HA] + [A—], и известной константе диссоциации Ka, а также концентрациях ионов водорода [H+] и гидроксид-ионов [OH—], выглядит так:
β = 2.303 * Cобщ * (Ka * [H+]) / (Ka + [H+])2 + 2.303 * ([H+] + [OH—])
Где:
- β – буферная емкость.
- 2.303 – множитель, переводящий натуральный логарифм в десятичный (ln(x) = 2.303 * log10(x)).
- Cобщ – общая молярная концентрация буфера (сумма [HA] и [A—]).
- Ka – константа диссоциации слабой кислоты.
- [H+] – молярная концентрация ионов водорода (можно найти как 10-pH).
- [OH—] – молярная концентрация гидроксид-ионов (можно найти как Kw / [H+], где Kw ≈ 10-14 при 25°C).
Первая часть уравнения учитывает вклад буферной пары, а вторая – вклад автопротолиза воды, который становится значимым при очень низких или очень высоких значениях pH. Максимальная буферная емкость достигается, когда pH = pKa, то есть когда [HA] = [A—]. В этом случае формула упрощается, и буферная емкость примерно пропорциональна общей концентрации буфера.
Пример расчета буферной емкости
Давайте рассчитаем буферную емкость для ацетатного буфера с общей концентрацией 0.1 M, приготовленного для pH 4.76 (что равно pKa уксусной кислоты).
Дано:
- Общая концентрация буфера (Cобщ) = 0.1 M
- pKa уксусной кислоты = 4.76, следовательно Ka = 10-4.76 ≈ 1.74 × 10-5
- Желаемый pH = 4.76, следовательно [H+] = 10-4.76 ≈ 1.74 × 10-5 M
- При 25°C, Kw = 10-14, поэтому [OH—] = Kw / [H+] = 10-14 / (1.74 × 10-5) ≈ 5.75 × 10-10 M
Теперь подставим эти значения в формулу Ван Слайка:
β = 2.303 * 0.1 * (1.74 × 10-5 * 1.74 × 10-5) / (1.74 × 10-5 + 1.74 × 10-5)2 + 2.303 * (1.74 × 10-5 + 5.75 × 10-10)
β = 2.303 * 0.1 * (3.0276 × 10-10) / (3.48 × 10-5)2 + 2.303 * (1.74 × 10-5)
β = 2.303 * 0.1 * (3.0276 × 10-10) / (1.21104 × 10-9) + 0;00004008
β = 2.303 * 0.1 * 0.25 + 0.00004008
β = 0.057575 + 0.00004008
β ≈ 0.0576 моль/(л·pH)
Таким образом, буферная емкость этого ацетатного буфера при pH 4.76 составляет примерно 0.0576 моль/(л·pH). Это означает, что для изменения pH 1 литра этого буфера на одну единицу потребуется добавить около 0.0576 моля сильной кислоты или основания.
Для удобства понимания переменных в формуле, мы составили небольшую таблицу:
| Переменная | Описание | Единицы измерения |
|---|---|---|
| β | Буферная емкость | моль/(л·pH) |
| Cобщ | Общая концентрация буфера | моль/л (M) |
| Ka | Константа диссоциации кислоты | безразмерная |
| [H+] | Концентрация ионов водорода | моль/л (M) |
| [OH—] | Концентрация гидроксид-ионов | моль/л (M) |
Графический метод
Помимо прямого расчета, мы часто используем графический метод для визуализации буферной емкости и определения оптимального рабочего диапазона. Построив график зависимости буферной емкости от pH, мы можем получить очень ценную информацию.
Такой график обычно имеет форму колокола или горы с пиком, соответствующим максимальной буферной емкости. Этот пик всегда находится при pH, равном pKa буферной системы. По мере удаления от pKa в обе стороны (как к более кислым, так и к более щелочным значениям), буферная емкость плавно снижается. Это интуитивно понятно: когда один из компонентов буферной пары становится очень мал по сравнению с другим, его способность нейтрализовать добавленные ионы резко падает.
Мы используем эти графики для:
- Определения оптимального диапазона pH: Область вокруг пика буферной емкости (обычно pKa ± 1) является наилучшим рабочим диапазоном для данного буфера.
- Сравнения различных буферных систем: На одном графике можно построить кривые буферной емкости для нескольких систем и быстро выбрать ту, которая лучше всего подходит для нужного pH и требует определенной "силы".
- Визуализации влияния концентрации: Увеличение общей концентрации буфера просто "поднимет" всю кривую буферной емкости вверх, но не изменит ее форму или положение пика.
Графический анализ дополняет математические расчеты, предоставляя более полную картину поведения буферной системы.
Оптимизация буферных систем: Искусство и наука
Выбор и создание идеальной буферной системы – это не просто слепое следование формулам, это настоящее искусство, сочетающее научные знания с практическим опытом. Нам приходится учитывать множество факторов, чтобы буфер не только работал, но и был эффективным, безопасным и экономически оправданным для конкретного применения.
Когда мы подходим к выбору буфера, мы всегда задаем себе следующие вопросы:
- Целевой диапазон pH: Это самый очевидный фактор. Мы выбираем буфер, pKa которого максимально близок к желаемому pH. Как мы уже говорили, оптимальная буферная емкость находится в пределах pKa ± 1.
- Требуемая буферная емкость: Насколько сильно система будет подвергаться воздействию кислоты или основания? Если ожидаются большие изменения, нам потребуется буфер с высокой концентрацией компонентов. Если изменения малы, можно обойтись более разбавленным раствором.
- Инертность и совместимость: Буфер не должен вступать в нежелательные реакции с другими компонентами раствора или образца. Например, некоторые буферы могут хелатировать ионы металлов, что критично в биологических системах. Мы всегда проверяем химическую совместимость.
- Температурные эффекты: Значения pKa большинства буферов зависят от температуры. Мы всегда учитываем рабочую температуру системы и при необходимости корректируем расчеты или выбираем буферы с минимальной температурной зависимостью (например, буферы Гуда, такие как HEPES, TRIS).
- Ионная сила: Константы диссоциации (и, следовательно, pKa) также могут меняться в зависимости от ионной силы раствора. Это особенно важно в физиологических средах или концентрированных растворах.
- Стоимость и доступность: В крупномасштабных промышленных процессах стоимость буферных компонентов может быть значительным фактором.
- Стерильность и токсичность: В биологических и фармацевтических применениях буфер должен быть стерильным и нетоксичным для клеток или организмов.
Проектирование буферной системы часто включает итеративный процесс: сначала мы делаем предварительный расчет, затем готовим пробный раствор, измеряем его pH и буферную емкость экспериментально, и при необходимости корректируем концентрации. Этот эмпирический подход в сочетании с теоретическими расчетами позволяет нам создавать по-настоящему надежные и эффективные системы.
Типичные ошибки и подводные камни при расчете буферной емкости
На нашем пути к мастерству в области буферной емкости мы, конечно же, сталкивались с множеством трудностей и совершали ошибки. И именно эти ошибки научили нас быть более внимательными и критичными. Мы хотим поделиться ими с вами, чтобы вы могли избежать этих распространенных подводных камней:
- Игнорирование температурных эффектов: Это одна из самых частых ошибок. Мы привыкли использовать значения pKa, приведенные для 25°C. Однако pKa многих буферов значительно изменяется с температурой. Например, pKa TRIS буфера сильно зависит от температуры (около -0.03 единицы pH на градус Цельсия). Если вы работаете при 4°C или 37°C, необходимо использовать соответствующие скорректированные pKa значения. Игнорирование этого фактора может привести к тому, что ваш буфер будет работать совсем не при том pH, на который вы рассчитывали.
- Некорректные значения pKa: Используемые pKa должны быть актуальными для конкретных условий (температура, ионная сила, иногда даже концентрация). Взятие "среднего" значения из общего справочника без учета контекста может привести к ошибкам. Всегда проверяйте источник данных.
- Предположение об идеальном поведении: Уравнение Гендерсона-Хассельбаха и формула Ван Слайка основаны на предположении об идеальных растворах. В очень концентрированных растворах или растворах с высокой ионной силой, реальные активности ионов могут значительно отличаться от их концентраций. В таких случаях требуются более сложные расчеты с использованием коэффициентов активности, что обычно выходит за рамки рутинных лабораторных задач, но важно для точных исследований.
- Неучет ионной силы: Ионная сила раствора влияет на кажущиеся значения pKa. В биологических буферах, которые часто содержат соли, это может быть важным фактором. Высокая ионная сила может сдвигать pKa, уменьшая буферную емкость в расчетном диапазоне.
- Эффекты разбавления: Хотя буферные системы относительно устойчивы к разбавлению по pH, их буферная емкость прямо пропорциональна концентрации. Разбавление буфера вдвое уменьшит его емкость вдвое, что может быть критично, если ожидается значительное добавление кислоты или основания. Мы всегда следим за тем, чтобы буферная емкость оставалась достаточной после всех этапов разбавления.
- Неправильный выбор компонентов: Некоторые буферные компоненты могут взаимодействовать с другими веществами в растворе. Например, фосфатные буферы могут выпадать в осадок с ионами кальция или магния, а TRIS может быть ингибитором некоторых ферментов. Всегда исследуйте потенциальные побочные реакции.
- Ошибка в измерениях: Неточный pH-метр, неправильная калибровка, ошибки при взвешивании или измерении объемов – все это напрямую влияет на точность приготовления буфера и, как следствие, на его реальную буферную емкость. Регулярная калибровка оборудования и тщательное соблюдение методик – залог успеха.
Осознание этих потенциальных ловушек позволяет нам подходить к расчету и приготовлению буферных растворов с гораздо большей осторожностью и точностью.
Практические применения буферной емкости: От лаборатории до производства
Понимание и расчет буферной емкости — это не просто академическое упражнение. Это краеугольный камень для множества практических приложений, которые затрагивают нашу жизнь каждый день. Мы видим буферную емкость в действии повсюду, от микроскопических процессов внутри клеток до огромных промышленных масштабов.
Вот лишь некоторые из ключевых областей, где буферная емкость играет решающую роль:
- Биологические системы и медицина:
- Кровь человека: Это, пожалуй, самый известный пример. Наша кровь содержит несколько буферных систем (бикарбонатная, фосфатная, белковая), которые поддерживают pH в чрезвычайно узких пределах (7.35-7.45). Отклонение от этих значений даже на 0.1-0.2 единицы может быть смертельным. Расчет буферной емкости крови помогает нам понять, как организм справляется с кислотно-щелочным дисбалансом.
- Культивирование клеток и тканей: В лабораториях для роста клеток используются питательные среды, которые должны поддерживать строго определенный pH. Буферы, такие как HEPES или фосфатные буферы, добавляются в эти среды, чтобы обеспечить стабильные условия для клеточного роста и жизнедеятельности.
- Разработка лекарств и вакцин: Стабильность многих фармацевтических препаратов зависит от pH. Буферы используются для поддержания оптимального pH в растворах для инъекций, каплях, сиропах, чтобы предотвратить деградацию активных ингредиентов и обеспечить их эффективность и безопасность.
- Пищевая промышленность и напитки:
- Сохранение продуктов: pH влияет на рост микроорганизмов и активность ферментов, которые могут испортить пищу. Буферы используются для поддержания pH в продуктах, таких как йогурты, сыры, фруктовые соки, чтобы продлить срок их хранения, сохранить вкус и текстуру. Например, лимонная кислота и цитрат натрия часто используются как буферная система в напитках.
- Производство пива и вина: Контроль pH на различных стадиях брожения критически важен для активности дрожжей, формирования вкуса и аромата.
- Экология и охрана окружающей среды:
- Буферизация почв: Почвы обладают естественной буферной емкостью, которая позволяет им сопротивляться изменениям pH, вызванным кислотными дождями или применением удобрений. Понимание этой емкости важно для сельского хозяйства и оценки воздействия загрязнений.
- Водные экосистемы: pH воды в озерах и реках влияет на выживание водных организмов. Буферные системы (например, карбонатные) помогают поддерживать стабильный pH, защищая экосистемы от резких изменений.
- Химическое производство и аналитическая химия:
- Оптимизация химических реакций: Многие химические реакции чувствительны к pH. Буферы используются для создания оптимальных условий, чтобы максимизировать выход продукта и минимизировать побочные реакции.
- Калибровочные растворы: pH-метры калибруются с использованием стандартных буферных растворов с точно известным pH.
- Хроматография: В жидкостной хроматографии буферы используются для контроля pH подвижной фазы, что критически важно для разделения и анализа различных соединений.
Этот список можно продолжать бесконечно, но он уже демонстрирует, насколько глубоко концепция буферной емкости интегрирована в наш мир. Мы, как исследователи, находим это захватывающим и вдохновляющим, поскольку каждый новый расчет и каждое новое понимание буферных систем открывают двери для инноваций и улучшений.
Вот мы и подошли к концу нашего обширного путешествия в мир буферной емкости. Мы начали с базового понимания того, что такое буферы и почему они так важны, затем углубились в математические основы с уравнением Гендерсона-Хассельбаха, и, наконец, освоили методы расчета буферной емкости, включая титрование и формулу Ван Слайка. Мы даже затронули искусство оптимизации буферных систем, рассмотрели типичные ошибки и подчеркнули бесчисленные практические применения этой фундаментальной концепции.
Что мы вынесли из этого? Главное — это осознание того, что буферная емкость не просто число, а критически важный параметр, который определяет стабильность и функциональность любой системы, где pH играет роль. Это понимание позволяет нам не просто наблюдать за химическими процессами, но и активно ими управлять, проектировать их, предсказывать их поведение и, в конечном итоге, создавать более эффективные, безопасные и надежные решения в самых разных областях – от спасения жизней в медицине до обеспечения качества продуктов на нашем столе.
Наш опыт показывает, что расчет буферной емкости – это не конечная точка, а скорее отправная точка для более глубокого понимания и контроля. Это непрерывный процесс обучения, экспериментирования и уточнения. Мы постоянно сталкиваемся с новыми вызовами и новыми буферными системами, и каждый раз мы возвращаемся к этим фундаментальным принципам, чтобы разгадать их тайны. Надеемся, что этот материал послужит вам надежным компасом в ваших собственных исследованиях и практической деятельности. Удачи в ваших буферных приключениях! На этом статья заканчивается.
Подробнее
| Буферные растворы применение | Как выбрать буфер | Уравнение Гендерсона-Хассельбаха примеры | Типы буферных систем | Влияние температуры на буфер |
| Буферная емкость крови | Расчет pH буферного раствора | Определение буферной емкости | Лабораторные буферы | Значение pKa для буферов |